细胞分选磁珠如何赋能高通量功能基因组学研究?
全基因组CRISPR-Cas9筛选是系统解析基因功能、发现新治疗靶点的核心技术。

- 最新进展
- 产品信息
最新进展
一、为何需要发展高通量细胞分选技术?
全基因组CRISPR-Cas9筛选是系统解析基因功能、发现新治疗靶点的核心技术。其原理在于利用向导RNA(gRNA)文库系统性敲除细胞中的每一个基因,然后通过监测特定表型(如细胞存活、蛋白表达变化、药物抵抗)在不同gRNA富集或耗竭情况下的变化,来反向推断基因功能。然而,为确保筛选覆盖度和统计效力,此类实验通常需要处理数亿乃至数十亿个细胞。传统的荧光激活细胞分选(FACS)尽管纯度高、可进行多参数分析,但其通量有限,且长时间的分选过程易导致细胞活力下降、代谢状态改变,尤其不适用于对细胞状态敏感的非生长性表型(如特定蛋白表达水平)的大规模筛选。因此,开发一种能快速、温和处理海量细胞的高通量分选技术,已成为推动功能基因组学发展的迫切需求。
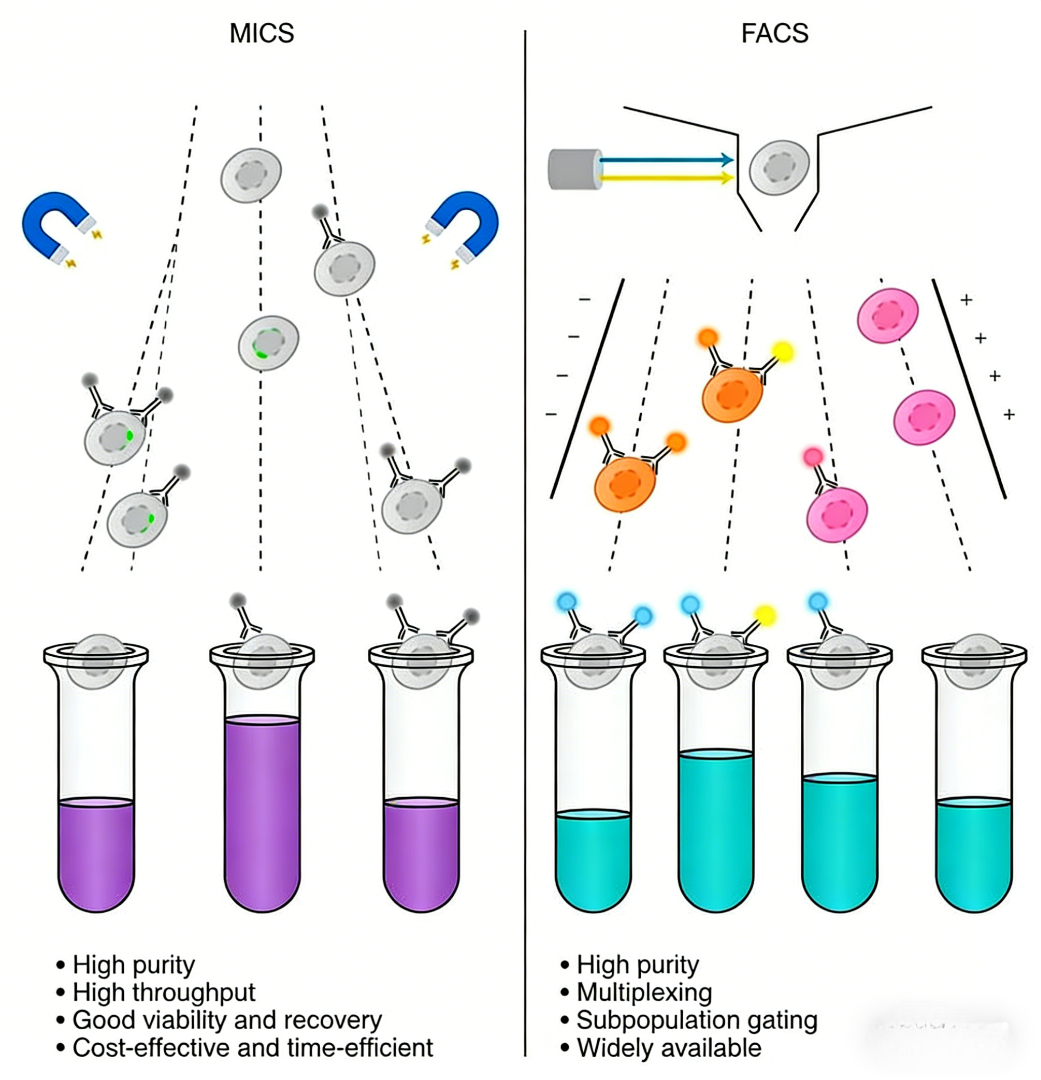
二、基于磁珠的微流控分选(MICS)技术原理是什么?
微流控免疫磁珠细胞分选(Microfluidic Immunomagnetic Cell Sorting, MICS)技术正是为应对上述挑战而发展起来的高通量解决方案。其核心原理在于将免疫磁珠分选与微流控芯片技术相结合,实现了对细胞群体的快速、批量分选。
1. 免疫磁珠标记:其基础是使用表面偶联了特异性抗体(如抗CD47抗体)的超顺磁性纳米颗粒(即细胞分选磁珠)对细胞进行标记。抗体与细胞表面靶抗原的结合,使磁珠特异性地附着在目标细胞上。细胞表面结合的磁珠数量通常与靶蛋白的表达水平成正比。
2. 微流控芯片分选:标记后的细胞悬液被注入特制的微流控芯片。芯片内集成了精密的磁场发生器(如永磁体或电磁铁)。当携带磁珠的细胞流经芯片内的特定通道时,会受到磁场力的作用,其偏转轨迹和程度取决于细胞表面磁珠的数量(即磁场强度)。通过芯片的流体动力学设计与磁场调控,可在瞬间同时对数百万个细胞进行分选,根据预设的磁场力阈值,将其高效地分离为不同的亚群,例如目标蛋白高表达、低表达及基线表达的细胞群体。
三、MICS技术与传统FACS相比有何优势与局限?
与基于荧光和静电偏转的FACS相比,MICS技术在应用于大规模CRISPR筛选时展现出独特的优势,同时也存在明确的适用范围。
核心优势:
1. 超高通量:MICS的分选速度可达每小时处理数十亿细胞,且可通过多芯片并行操作进一步扩展通量,完全满足全基因组筛选对海量细胞处理的需求。
2. 卓越的细胞活性与回收率:分选过程在密闭微流道中快速完成,避免了FACS中可能存在的鞘液压力、电荷施加及长时间暴露于激光等物理应激,从而更好地保持了细胞的活力、功能和原始状态,回收率也更高。
3. 操作简便与成本效益:无需复杂的激光系统、光电倍增管和液滴生成装置,设备相对简化。高通量特性显著缩短了实验周期,降低了单位细胞的分选成本和时间成本。
当前技术局限:
1. 分选维度单一:通常仅能基于单个表面标志物(一种磁珠标记)进行分选,难以像FACS那样同时利用多个荧光通道进行多参数、高维度的细胞表型分析。
2. 分选策略固定:分选门控(阈值)依赖于芯片的物理设计和磁场设置,一旦制作完成,难以在实验过程中像FACS软件那样灵活、实时地调整分选边界或比例。
3. 缺乏形态学预筛:无法在分选前基于前向散射(FSC)和侧向散射(SSC)信号排除死细胞、细胞聚集体或根据细胞大小/颗粒度进行预筛。
四、MICS在CRISPR筛选中如何应用并推动靶点发现?
MICS技术已成功整合到全基因组CRISPR筛选流程中,并展现出强大应用价值。其标准流程包括:(1)用全基因组CRISPR敲除文库转导细胞池;(2)在特定条件下培养或刺激,使不同基因敲除细胞产生目标表型差异(如CD47蛋白表达量变化);(3)使用针对该表型标志物(如CD47)的免疫磁珠,通过MICS技术将细胞高效分选为高、低表达等不同亚群;(4)分别从各亚群中提取基因组DNA,对gRNA序列进行深度测序和生物信息学分析,鉴定出导致表型变化的调控基因。
一项代表性研究利用该策略,成功筛选出调控免疫检查点分子CD47表达的关键基因QPCTL(谷氨酰胺肽环转移酶样蛋白)。QPCTL被证实是CD47蛋白翻译后修饰所必需的酶,影响其与配体SIRPα的结合。这一发现不仅揭示了CD47表达调控的新机制,也为开发旨在增强CD47靶向疗法疗效的联合策略提供了全新靶点,验证了MICS辅助CRISPR筛选在发现治疗相关基因方面的实用性与高效性。
五、提供细胞分选磁珠的厂商有哪些?
杭州斯达特生物科技有限公司自主研发的 “CD8纳米磁珠,小鼠(仅供研究用)(CD8 Nanobeads, mouse (RUO))”(货号:S0K0005),是一款基于纳米磁珠技术、具有高特异性、高回收率及操作便捷的高性能细胞分选试剂。本品将高亲和力的抗小鼠CD8a单克隆抗体共价偶联至超顺磁性纳米微球,可从脾脏、淋巴结、外周血或肿瘤组织单细胞悬液等复杂样本中,快速、温和地分离出高纯度的小鼠CD8阳性T细胞,是肿瘤免疫学、感染免疫学及细胞治疗研究的关键工具。
| 产品核心优势 |
|---|
| 高特异性与优异的分选纯度: 采用经严格筛选的高质量抗小鼠CD8a单克隆抗体,确保对小鼠细胞毒性T细胞(CTL)表面CD8a抗原的特异性识别。纳米磁珠尺寸均一,结合效率高,能有效标记目标细胞,分选后细胞纯度通常可达95%以上,为下游高要求的实验(如单细胞测序、体外功能分析、过继性转移)提供高质量的细胞群体。 |
| 温和高效的纳米级磁珠设计: 纳米级磁珠体积小,对细胞膜的压力和干扰极小,分选过程温和,能最大程度地保持细胞的天然活性、表型和功能(如增殖能力、细胞因子分泌、杀伤活性)。磁珠无需解离即可直接用于后续实验,简化了流程并保障了细胞的最佳状态。 |
| 操作简便、快速,兼容多种样本类型: 基于磁珠的“标记-磁性分离”流程简单直观,无需大型分选仪器,仅需配合磁性分离架即可在常规实验室环境中完成。整个过程耗时短,适用于从脾脏、淋巴结、外周血及实体瘤(经消化制备)等多种小鼠来源样本中快速富集CD8+ T细胞。 |
| 关键的应用价值 |
|---|
| CD8+ T细胞的分离与功能研究: 用于从正常或疾病模型小鼠中快速获取高纯度、高活力的CD8+ T细胞,进行体外活化、扩增、细胞因子检测、杀伤实验或表型分析。 |
| 肿瘤免疫与过继性细胞治疗研究: 作为制备肿瘤浸润淋巴细胞(TIL)或工程化T细胞(如CAR-T)的关键起始步骤,为小鼠肿瘤模型的过继性细胞治疗研究提供纯净的效应细胞来源。 |
| 感染免疫研究: 用于从病毒感染(如LCMV、流感病毒)的小鼠模型中分离抗原特异性或总CD8+ T细胞,研究其应答动力学、记忆形成及功能。 |
| 免疫分型与免疫监测: 可快速从复杂免疫细胞悬液中富集CD8+ T细胞,以便进行更精细的亚群分析(如 naïve, effector, memory)或下游检测。 |
| 基因工程小鼠模型验证: 用于验证特定基因修饰对CD8+ T细胞发育、稳态或功能的影响。 |
专业技术支持: 我们提供该产品的详细操作手册,包括针对不同组织样本的优化制备方案、标准分选流程及注意事项。我们的技术团队可提供专业的技术咨询与实验设计支持。
杭州斯达特生物科技有限公司始终致力于为免疫学研究与小鼠疾病模型研究提供高效、可靠、标准化的细胞分离解决方案。如需了解更多关于 “CD8纳米磁珠,小鼠(RUO)”(货号S0K0005)的详细信息、获取技术资料或申请试用,欢迎随时与我们联系。
产品信息
声明:本篇文章在创作中部分采用了人工智能辅助。如有任何内容涉及版权或知识产权问题,敬请告知,我们承诺将在第一时间核实并撤下。
上一篇 下一篇


